揭示Insig监控细胞固醇含量的机制
清华大学颜宁研究组在《科学》发表论文
报道胆固醇感应蛋白Insig在分支杆菌中同源蛋白结构
清华新闻网7月10日电 7月10日,清华大学医学院颜宁研究组在《科学》(Science)发表题为《分枝杆菌Insig同源蛋白晶体结构揭示Insig蛋白感受固醇的分子机制》(Crystal structure of a mycobacterial Insig homolog provides insight into how these sensors monitor sterol levels)的研究论文,报道了一类分支杆菌中Insig同源蛋白MvINS的高分辨率晶体结构,并通过大量生化分析揭示了人源Insig蛋白感受调控细胞内固醇类分子水平的生化机制。生命学院博士生任若冰和周芯卉为本文的共同第一作者,颜宁教授为本文的通讯作者。
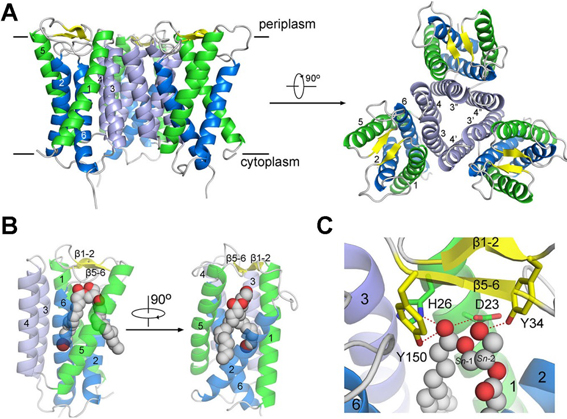
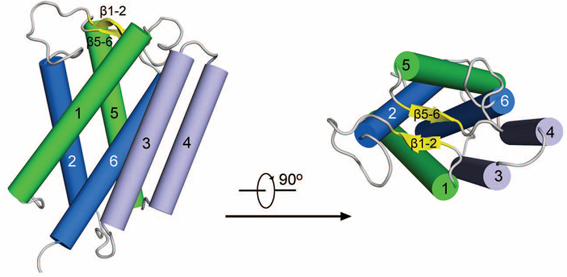
图为MvINS的晶体结构以及MvINS与DAG相互作用示意图。
胆固醇广泛地存在于高等动物的各类组织、细胞当中,调控细胞膜的流动性,是胆酸、维生素D以及一些类固醇激素的前体,参与重要的细胞信号转导。动物体内过量的胆固醇积累会促进动脉粥样硬化的发生和发展,最终有可能导致严重的心血管疾病,诸如心脏病及中风。因此,在高等动物体内有一套严格的负反馈调控机制,通过SREBP(Sterol Regulatory Element-Binding Protein)通路,调控胆固醇的摄取及合成,控制血液及细胞内的胆固醇含量。在SREBP通路中,内质网上的二次跨膜蛋白SREBP2的氨基端结构域是调控胆固醇合成与摄取相关基因的转录因子。Insig是位于内质网上的一类含有六次跨膜螺旋的膜蛋白,在结合类固醇分子(如25-羟基胆固醇,简称25HC)的情况下,可以通过Scap介导,与SREBP2形成复合物,将SREBP2滞留在内质网上,从而降低细胞内胆固醇的合成和摄取。尽管对于SREBP通路的细胞生物学与生物化学性质有了相当多的认识和理解,但受限于真核膜蛋白在纯化、结晶等方面的技术难度,这个领域的结构生物学研究异常缓慢。
颜宁研究组通过序列分析发现Insig蛋白在七种分支杆菌中有同源蛋白,她们将Mycobacterium vanbaalenii中的同源蛋白命名为MvINS,并解析了其分辨率高达1.9埃的晶体结构。通过结构分析,推测MvINS可能结合一种重要的脂类小分子二酰基甘油(DAG),并最终获得了分辨率为2.1埃的MvINS/DAG复合物结构。随后作者基于MvINS的晶体结构,通过同源建模构建了人源Insig的三维结构模型,在此基础上设计大量的Insig突变体检验与Scap的相互作用,从而推测出25HC与Insig可能的结合区域,以及Insig与Scap可能的相互作用界面。这项研究结果为高等生物Insig蛋白的结构生物学和生物化学研究提供了有力的支持,对进一步研究Insig在SREBP通路的作用以及工作机理具有重要的意义。
此项研究与北京生命科学研究所雷晓光教授,罗氏(上海)的Frank S. Yan博士以及美国德克萨斯大学西南医学中心Arun Radhakrishna教授等合作完成,获得了两位诺贝尔奖得主、SREBP通路的发现者Mike Brown和Joe Goldstein教授的支持和帮助。本研究项目受到科技部重大科学研究计划、清华-北大生命科学联合中心及HHMI的资助。
颜宁教授自2007年回国旋即开展了针对SREBP通路的系统的结构生物学与生物化学研究,近年终于取得一系列进展。这是她们继2015年3月在《细胞研究》(Cell Research)报道了酵母中SREBP通路的Scap蛋白调控结构域结构(http://www.nature.com/cr/journal/v25/n4/full/cr201532a.html)之后的又一重要成果。
论文链接:http://www.sciencemag.org/content/349/6244/187.full
编辑:襄桦