清华生命学院陈柱成与李雪明课题组合作在《自然》发文阐述染色质重塑机理
清华新闻网4月22日电 4月19日,清华大学生命科学学院陈柱成课题组和李雪明课题组合作在《自然》(Nature)杂志上以长文(Research Article)形式在线发表题为《Snf2-核小体复合物结构揭示的染色质重塑机理》(Mechanism of chromatin remodeling revealed by the Snf2-nucleosome structure)的研究论文,阐述了Snf2蛋白与底物核小体的结合方式及染色质重塑发生的机理。
在真核生物细胞内,DNA缠绕着组蛋白八聚体形成染色质的基本组成单位—核小体。染色质在包装、保护遗传物质方面发挥着关键作用。然而染色质形成同时对细胞内的一些生理过程,如DNA复制、转录、修复等产生了巨大的障碍。SWI/SNF家族染色质重塑蛋白复合物通过利用ATP水解的能量调控染色质的结构,广泛参与调控干细胞分化、重编程、免疫应答、学习和记忆、癌症等不同的生物学过程。染色质重塑复合物从酵母到人都保守,但其发挥功能的分子机理尚不了解,是长期存在的染色质生物学领域的基本问题。
陈柱成课题组于2016年在《自然结构与分子生物学》(NSMB)发表的论文解析了Snf2蛋白基态晶体结构,阐释了Snf2的自抑制机理。然而该蛋白结合底物核小体的结构仍是未知。国际上其它研究组解析的染色质重塑复合物与核小体结合的结构分辨率都在20 埃左右的水平,只能从轮廓及空间大小推测核小体的结合位置,无法解析更深层次的生物学问题,如蛋白与底物核小体之间是怎样相互作用,蛋白又是怎样利用ATP水解的能量改变核小体结构等等这些问题都无从知晓。
本研究通过冷冻电镜单颗粒技术,成功获得了Snf2-核小体复合物分辨率为4.69 埃的电镜结构(图a)。通过对比本实验室之前解出的Snf2蛋白的晶体结构和复合物的电镜结构发现,Snf2蛋白结合核小体以后,两个主结构域( core1 and core2)之间发生了约80°的旋转。这个巨大的构象变化产生了一个由SuppH 螺旋和Brace 螺旋介导的相互作用的新界面,同时把结构要素I 和VI 拉到一起,这就揭示了核小体能够激发Snf2蛋白ATP酶活的机理(图b)。与人们以前一直认为的Snf2是插到DNA与组蛋白之间发挥功能的模型不同,结果显示,Snf2主要通过多个保守的解旋酶结构要素和核小体DNA的磷酸骨架结合,这也解释了染色质重塑复合物与DNA结合的序列非特异性,同时也揭示了一个普遍的染色质重塑蛋白与底物结合的机制(图c)。生物化学实验表明,Snf2的这个构型是耦合ATP水解和染色质重塑的关键(图d)。研究同时指出, Snf2蛋白打破局部的DNA与组蛋白的相互作用,使结合位点处的DNA发生形变。该研究推断,ATP结合和水解,使得Snf2发生进一步结构改变,从而把这个DNA形变推送出去,这与文献中染色质重塑的“DNA波”模型一致(图e)。这个研究解析了第一个染色质重塑蛋白与底物核小体结合的高分辨结构,首次揭示了染色质重塑的机理。
清华大学生命科学学院陈柱成研究员和李雪明研究员为本文的共同通讯作者;清华大学生命科学学院博士研究生刘晓玉、李美静、夏显为本文的共同第一作者 (图f)。国家蛋白质科学研究(北京)设施清华大学冷冻电镜平台为数据收集提供了支持,清华大学高性能计算平台为数据处理提供了支持。本研究获得了清华大学结构生物学高精尖创新中心、清华-北大生命科学联合中心、科技部和国家自然科学基金委的支持。
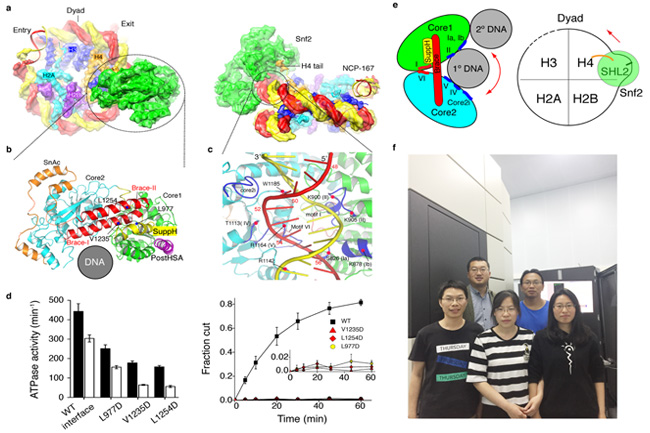
Snf2-核小体复合物结构及染色质重塑机理。(a) Snf2-核小体复合物电子显微镜结构的两个不同视角,虚线部分在(b)、(c)放大再分析;(b) 激活状态的Snf2结构;(c) Snf2-DNA 相互作用;(d)基于结构的Snf2活性分析(左图,ATP水解活性;右图,染色质重塑活性);(e) Snf2染色质重塑机理模型,双箭头(左图)表示Snf2的两个主结构域的相对运动方向,单箭头(右图)表示“DNA 波”传递方向;(f) 染色质重塑研究团队(前排左起:夏显,刘晓玉,李美静;后排:李雪明,陈柱成)。
原文链接:
http://www.nature.com/nature/journal/vaop/ncurrent/full/nature22036.html
编辑:华山 襄桦